01、工业化与生活模式转变加剧代谢性疾病负担
工业化与生活模式转变导致代谢性疾病激增,预计2045年全球糖尿病患者将达7.84亿,其并发症糖尿病肾病(DKD)作为慢性肾病主因,通过高血糖驱动的代谢紊乱使终末期肾衰竭风险增10倍,并占全球慢性肾病病例的25%-40%,构成重大健康威胁。
饮食模式的西化以高糖、高脂、低纤维为特征,显著重塑了人类肠道菌群结构,导致微生物多样性锐减及功能失衡。这种生态紊乱通过多重机制加剧代谢性疾病风险:菌群代谢产物谱改变可诱发胰岛素抵抗,肠道屏障功能受损引发内毒素移位,慢性低度炎症反应持续损伤胰腺β细胞及肾脏组织。值得注意的是,发展中国家群体因膳食纤维摄入量较高,其肠道菌群多样性及短链脂肪酸(SCFAs)产生菌丰度普遍优于发达国家,这与其较低的代谢综合征发病率存在显著关联。
02、Akkermansia muciniphila:肠道生态的守门菌与代谢健康调节器
疣微菌门核心成员Akkermansia muciniphila(AKK)因其独特的生态调节功能脱颖而出。作为健康肠道黏膜的"守门菌",AKK通过降解黏蛋白产生SCFAs,不仅为肠上皮细胞提供能量底物,更经FFAR2/3受体信号通路激活调节性T细胞(Treg),构建肠道免疫稳态。流行病学数据显示,AKK丰度与肥胖、糖尿病发病率呈显著负相关,而补充该菌可显著改善超重/肥胖人群的胰岛素敏感性(HOMA-IR降低27%)、降低血浆总胆固醇(降幅达15%),并恢复肠道屏障完整性。这种"菌群-代谢物-宿主"的交互作用网络,使AKK成为干预代谢性疾病及糖尿病肾病(DN)的理想靶点,其通过调节肠道生态平衡阻断代谢综合征-慢性肾病恶性循环的潜力亟待深入挖掘。
03、南昌大学研究:AKK菌调节肠道菌群改善糖尿病肾病机制
南昌大学聂少平团队利用转基因小鼠模型,将六周龄SPF级雄性C57BL/6(Lepr)wt/wt野生型小鼠与BKS-Leprem2Cd479db/Gpt(db/db)糖尿病模型小鼠分为三组,在严格控制的饲养条件下(12小时光照-黑暗循环,湿度50±10%,温度23±2°C),对野生型对照组(n=10)和db/db模型组(n=12)给予溶剂,而对AKK干预组(n=11)每日灌胃1.0×109?CFU AKK悬液(AKK为善恩康自主研发的AKK PROBIO菌,保藏编号为CGMCC No.20955),持续8周。研究监测了小鼠的代谢指标(体重、空腹血糖、葡萄糖耐量)、肾功能(血尿素氮、血清肌酐、尿白蛋白及尿白蛋白肌酐比)、氧化应激与炎症指标(丙二醛、抗氧化酶活性、炎症因子表达),并分析了肠道菌群变化。
04、AKK改善葡萄糖代谢与血脂异常
本研究对db/db糖尿病小鼠实施了为期8周的AKK菌口服干预,并每两周监测代谢指标变化。结果显示,随着治疗周期延长,AKK干预组小鼠的空腹血糖水平呈现渐进式下降趋势,至干预结束时较模型组显著降低(p<0.0001),表明AKK具有持续稳定的降糖作用。尽管葡萄糖耐量试验(GTT)结果未达统计学显著性(p=0.098),但曲线趋势显示AKK干预可轻微改善葡萄糖代谢能力。
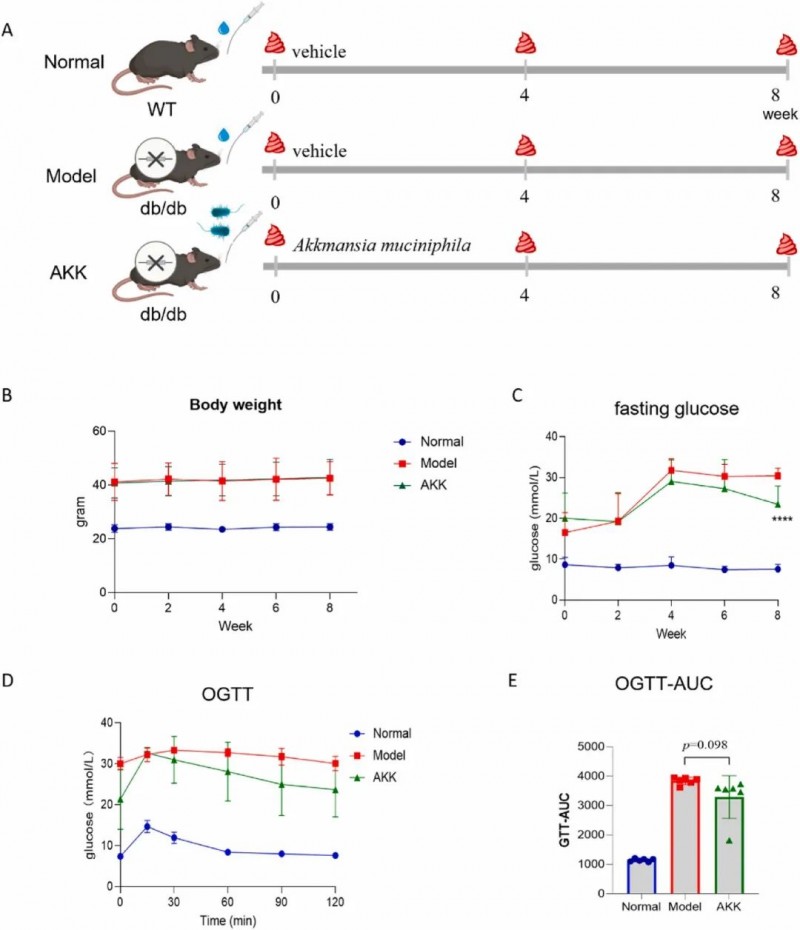
图1. Akkmansia muciniphila 补充对db/db 小鼠葡萄糖代谢的影响。
在治疗后测量了小鼠的血脂水平。AKK显著降低了小鼠血清中甘油三酯(TG)(F (2,21) = 195.8, p < 0.0001)、总胆固醇(TC)(F (2,21) = 73.71, p < 0.0001)和低密度脂蛋白胆固醇(LDL-C)(F (2,21) = 331.9, p < 0.0001),并增加了高密度脂蛋白胆固醇(HDL-C)的水平(F (2,21) = 125.6)。
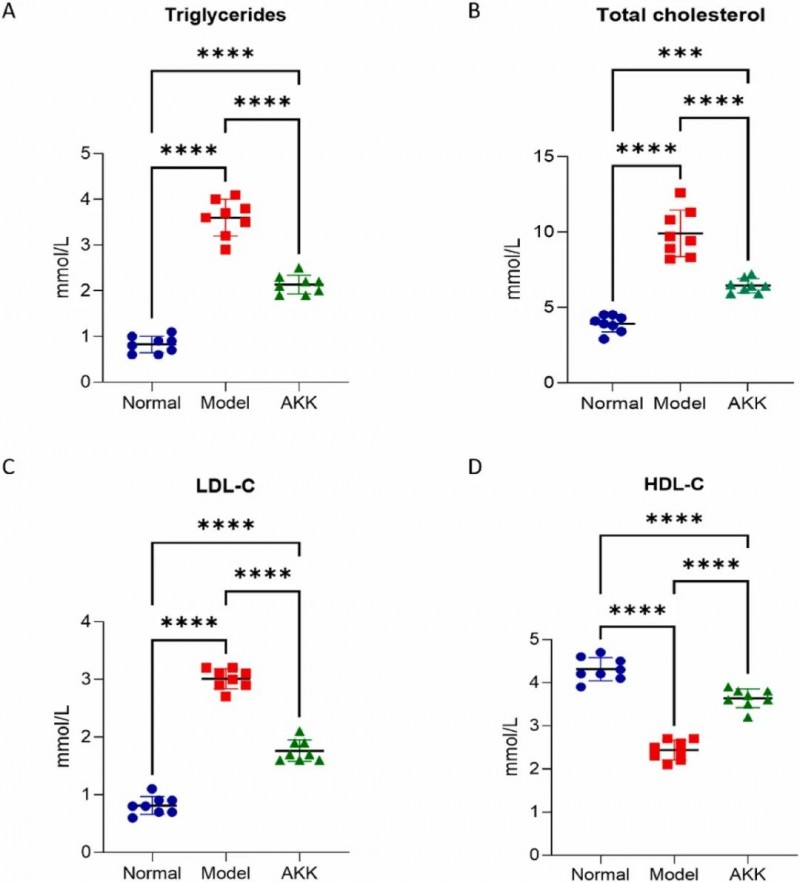
图2. Akkmansia muciniphila 补充对db/db 小鼠血清脂质谱的影响。
05、AKK对肾功能的保护作用
本研究通过建立DKD模型,证实db/db小鼠的肾功能指标显著异常:与野生型小鼠相比,其血尿素氮(BUN,F(2,21)=69.78,p<0.0001)、血清肌酐(F(2,21)=180.4,p<0.0001)及尿白蛋白(F(2,21)=605.7,p<0.0001)水平均大幅升高,明确提示肾脏损伤。经8周AKK干预后,上述指标均显著改善,表明AKK治疗可有效逆转DKD相关的肾功能异常。尤其值得注意的是,作为评估微量白蛋白尿的核心诊断指标,尿白蛋白肌酐比(UACR)在模型组中呈现极端升高(F(2,21)=249.6,p<0.0001),而AKK干预使其水平显著回落。
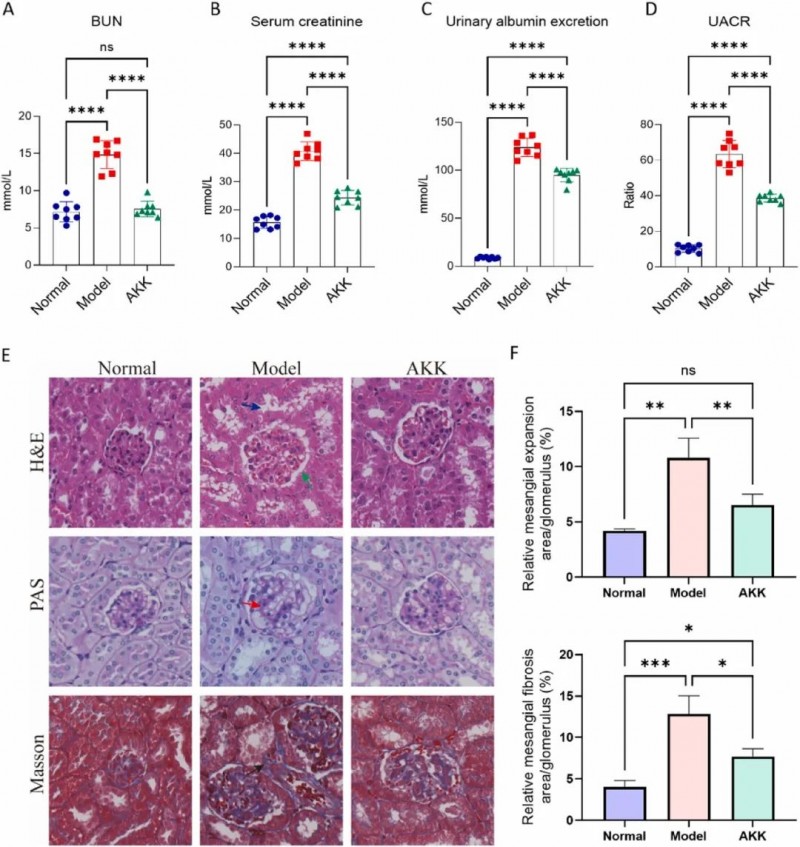
图3. 补充Akkermansia muciniphila对 db/db小鼠肾功能的影响。
06、AKK缓解肾脏氧化应激损伤
本研究表明AKK治疗显著DKD小鼠肾脏的氧化应激状态。与野生型小鼠相比,db/db模型组小鼠肾脏中丙二醛(MDA,反映脂质过氧化水平)含量显著升高,而AKK干预后MDA水平显著降低(F(2,21)=23.01, p<0.0001, AKK组vs模型组p<0.01)。同时,模型组小鼠肾脏的超氧化物歧化酶(SOD)、过氧化氢酶(CAT)及谷胱甘肽过氧化物酶(GSH-Px)活性均较野生型显著下降,但AKK治疗显著恢复了这三种关键抗氧化酶的活性(SOD:F(2,21)=53.90, p<0.0001,AKK组vs模型组p<0.001;CAT:F(2,21)=21.58, p<0.0001,p<0.05;GSH-Px:F(2,21)=32.79, p<0.0001,p<0.05)。
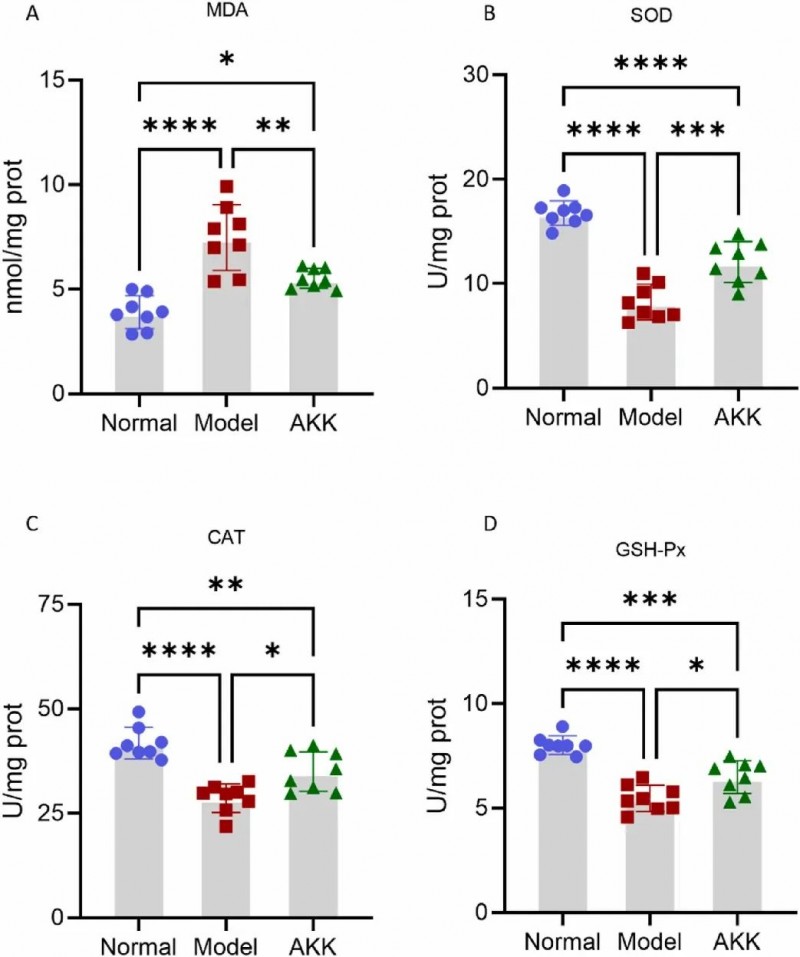
图4. 补充Akkermansia muciniphila对 db/db小鼠氧化应激的影响。
07、AKK抑制肾脏炎症级联反应
研究发现,AKK通过抑制TLR4/NF-κB炎症通路,显著降低肾脏中TLR4受体及磷酸化NF-κB水平,阻断炎症信号激活;同时下调MMP9表达(F(2,6)=9.705, p<0.05),抑制炎症巨噬细胞迁移。实验进一步证实,AKK减少NF-κB核转位,降低其转录活性,并显著降低肾脏中TNF-α(降低59.2%)、IL-1β(降低62.4%)、IL-6及MMP9蛋白水平(p<0.05-0.0001)。
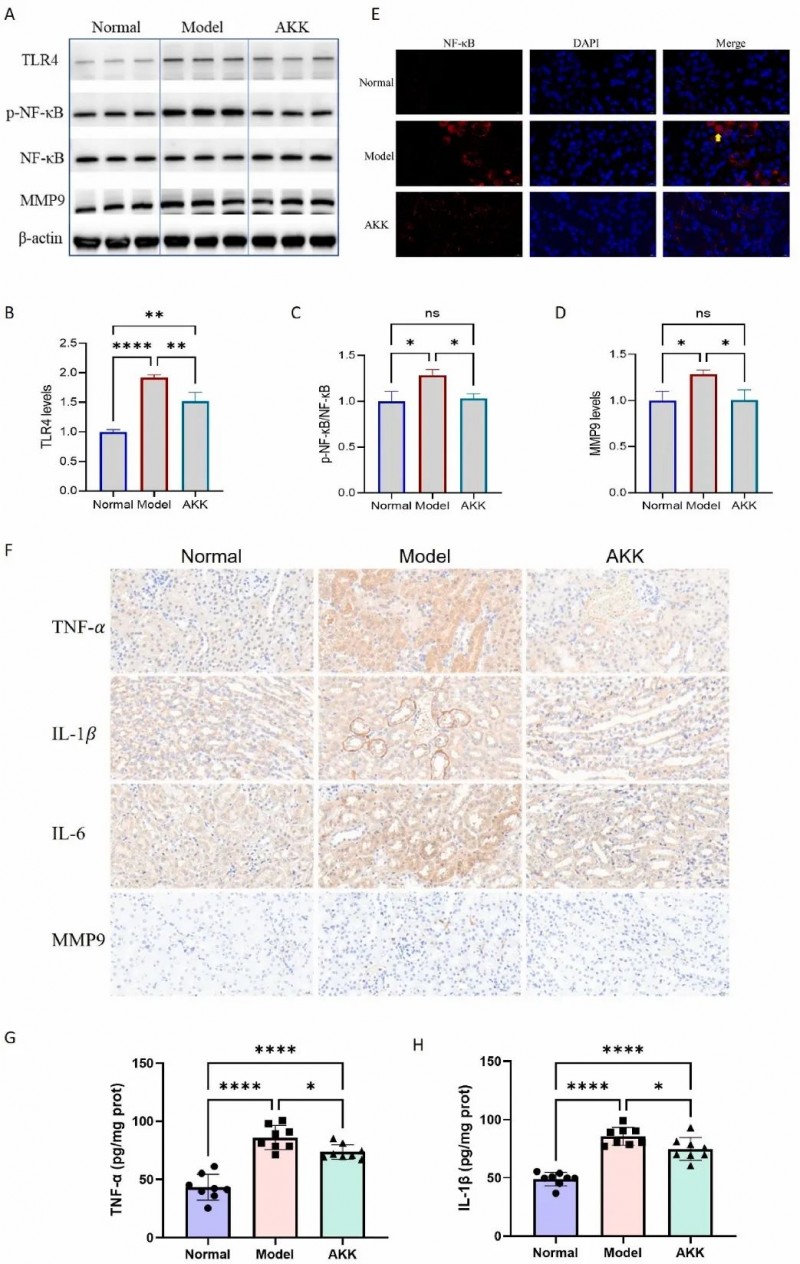
图5. 补充Akkermansia muciniphila对 db/db小鼠肾脏炎症的影响。
08、AKK重塑肠道菌群结构与多样性
研究通过主坐标分析(PCoA)和非度量多维尺度分析(NMDS)对小鼠肠道菌群进行物种水平的降维分析,结果显示AKK干预组与模型组的肠道菌群结构存在显著差异。进一步分析表明,AKK干预显著增加了肠道菌群的物种丰富度,这一点通过丰度覆盖估计器(ACE)指数(p < 0.05)和观测到的物种数量得到了证实,表明AKK对肠道微生态具有调节作用。
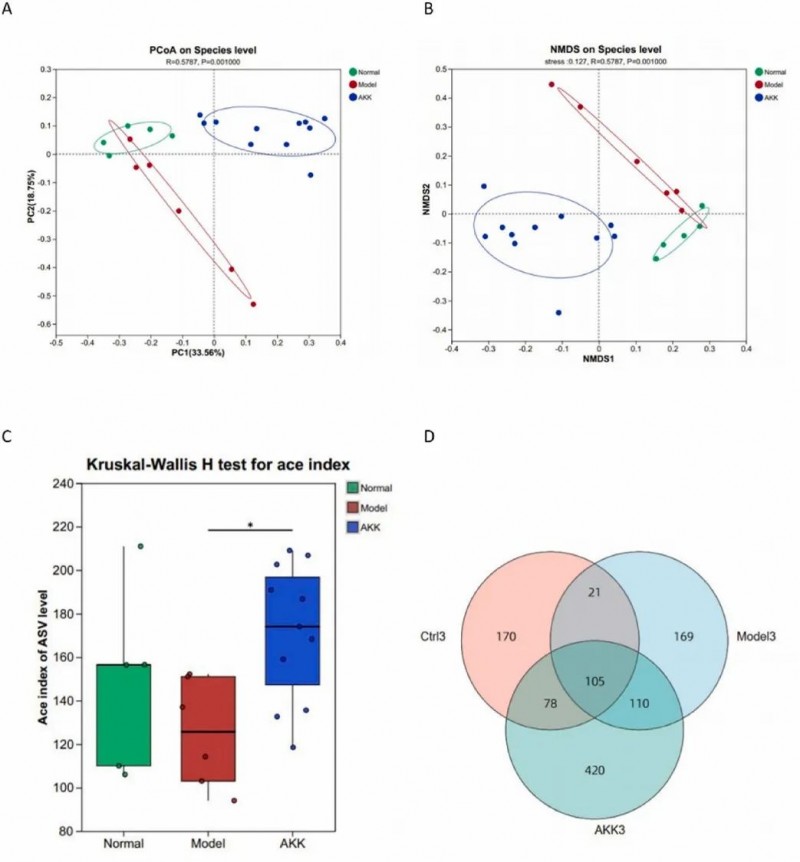
图6. 补充Akkermansia muciniphila对 db/db小鼠肠道菌群结构的影响。
09、AKK动态改善肠道生态稳定性
研究动态监测了野生型对照组、db/db模型组及AKK干预组三组小鼠在干预前、干预期间及干预后的肠道菌群多样性变化。结果显示,AKK干预显著改善了肠道微生态失衡,具体表现为干预后AKK干预组的α多样性指标(包括ACE、Chao1、sobs、Shannon、invsimpson、Shannoneven、Simpsoneven、Pielou's evenness及系统发育多样性)均显著高于db/db模型组(所有p<0.01,Simpsoneven除外,p<0.05),而反映优势菌群集中度的Simpson指数则显著降低(p<0.01),表明AKK干预有效提升了菌群丰度、均匀度及系统发育多样性。值得注意的是,在干预前及干预期间,AKK组与模型组的各项菌群指标并无显著差异,但随着干预的持续进行,db/db小鼠的菌群多样性呈现出进行性下降的趋势,而AKK干预则成功遏制了这一趋势,有效维持了肠道生态的稳定性。
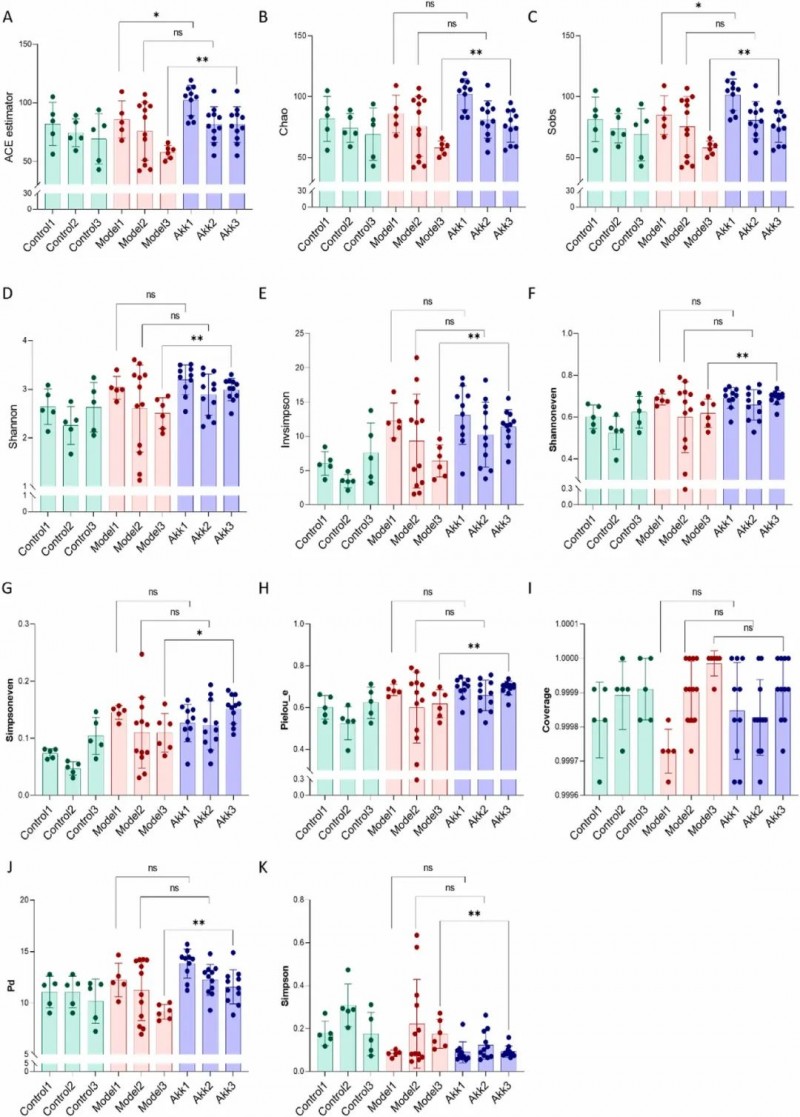
图7. 补充Akkermansia muciniphila对 db/db小鼠肠道菌群多样性的影响。
10、跨域调控:AKK靶向特定菌属改善代谢-肾脏轴
通过分析AKK对肠道微生物的调控方向与微生物-代谢参数相关性,揭示了其肾脏保护作用的潜在机制。研究发现,AKK干预后,与肾功能参数呈负相关的Duncaniella muris丰度显著上调,而与代谢参数呈正相关的s_unclassified_f_Lachnospiraceae丰度被下调。这种调控方向与微生物-代谢参数相关系数符号的一致性表明,AKK并非随机改变菌群结构,而是通过选择性调节特定菌属(如促进有益菌Duncaniella muris、抑制潜在有害菌Lachnospiraceae科未分类菌)来改善代谢紊乱和肾功能损伤。
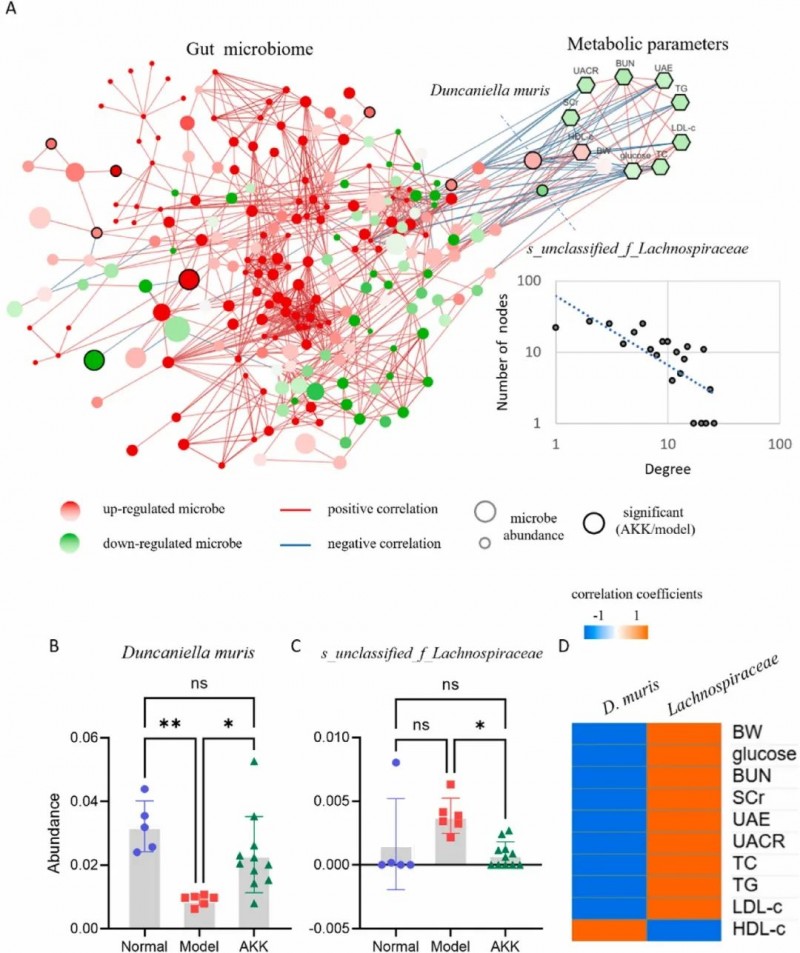
图8. 跨域网络分析揭示了可能介导Akkermansia muciniphila 补充对代谢参数调节的重要肠道微生物。
南昌大学聂少平团队研究证实,AKK通过肠-肾轴多靶点调控显著改善db/db小鼠DKD:该菌株可抑制肾脏氧化应激(降低MDA水平、恢复SOD/CAT/GSH-Px活性)与炎症反应(阻断TLR4/NF-κB通路、下调TNF-α/IL-1β/MMP9表达),同时缓解肾小球硬化及肾小管间质纤维化病理改变,最终逆转肾功能损伤(改善BUN/Scr/尿白蛋白指标)。机制研究表明,AKK通过重塑肠道菌群结构(富集Duncaniella muris、抑制Lachnospiraceae)构建菌群-代谢物-宿主轴,为微生物靶向干预代谢性肾病提供新策略。
参考文献
Liao, Z., Zhou, J., Lin, J., Zhu, Y., Feng, J., Cheng, Z., Li, X., Li, Z., & Nie, S. (2025). Supplementation of Akkermansia muciniphila improves diabetic kidney disease by regulating gut microbiome in db/db mice. Food Bioscience, 69, 107042.?https://doi.org/10.1016/j.fbio.2025.107042
Liao, Z., Zhou, J., Lin, J., Zhu, Y., Feng, J., Cheng, Z., Li, X., Li, Z., & Nie, S. (2025). Supplementation of Akkermansia muciniphila improves diabetic kidney disease by regulating gut microbiome in db/db mice. Food Bioscience, 69, 107042.?https://doi.org/10.1016/j.fbio.2025.107042
来源:食品伙伴网食品研发创新服务中心-功能食品圈,作者简介: Joy,食品营养与卫生专业研究生,目前从事功能食品产品研发工作。图片来源:创客贴会员。
提醒:文章仅供参考,如有不当,欢迎留言指正和交流。且读者不应该在缺乏具体的专业建议的情况下,擅自根据文章内容采取行动,因此导致的损失,本运营方不负责。如文章涉及侵权或不愿我平台发布,请联系处理。









